Здоровый образ жизни в условиях мегаполиса
Всегда актуально
Мы поможем быть в курсе последний течений в сфере здорового образа жизни!
Недавно мы обсуждали с вами разные активаторы молекуляного комплекса mTOR и разобрали лейцин Лейцин и mTORС: между акне и бицепсом., а еще ранее метионин и содержащие их продукты питания. Парадокс низкометиониновой диеты. Сегодня мы поговорим про другую группу активаторов, которая объединяет несколько пересекающихся гормонально-метаболических путей. Речь пойдет в первую очередь про инсулин, инсулиноподобный фактор роста-1 и в меньшей степени про гормон роста. Также обращаю ваше внимание, что глюкоза сама по себе является активатором mTOR.Ослабление сигналов от этих путей на различных стадиях продлевает жизнь самым разным модельным организмам, и на настоящий момент не осталось сомнений, что регуляция именно этих путей — главный рычаг воздействия рациона на здоровье и долголетие. Начало темы в Как меньше жрать и дольше жить.
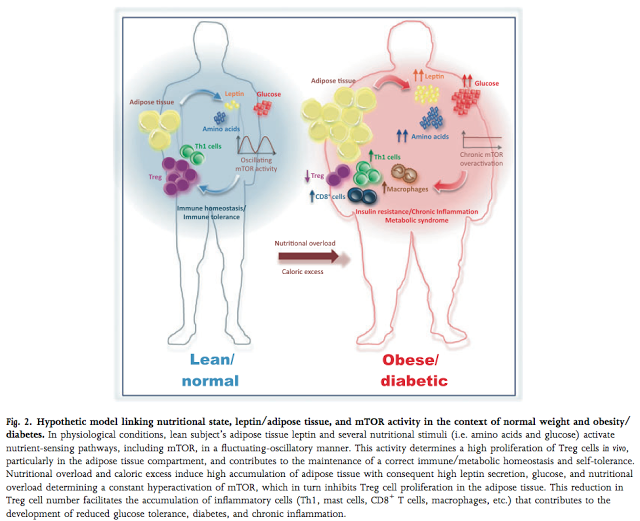
Инсулиновый каскад сильно консервативен у различных групп животных (позвоночных и беспозвоночных). Если у беспозвоночных животных insulin/ИФР1 — путь один, у высших позвоночных, в том числе, млекопитающих, этот путь подразделяется на два. Эти два пути имеют перекрывающиеся функции, но инсулин главным образом участвует в регуляции метаболизма, а ГР/ИФР1 путь играет важную роль в процессах роста, развития и, возможно длительности жизни.
Сигнальный путь IIS (insulin and IGF-1 signaling) информирует клетку о наличии глюкозы через уровень инсулина в крови. Путь IIS берет начало от мембранного рецептора, распознающего инсулин или инсулиноподобный фактор роста (IGF1), и затем распространяется по клетке, стимулируя ее рост и деление и инактивируя транскрипционные факторы FOXO (регулируют стресс-ответ, репарацию ДНК, клеточную смерть, аутофагию и др). Углеводы, содержащиеся в пище, в зависимости от строения, по-разному влияют на уровень инсулина в крови. Чем проще структура углевода, тем быстрее он переваривается и поступает в кровь, инициируя выработку инсулина.
ИФР-1 производится в печени в ответ на стимуляцию их соматотропиновых рецепторов или благодаря повышению уровня инсулина. Уровень ИФР-1 в крови зависит от действия на печень не только соматотропного гормона, но и половых стероидов итиреоидных гормонов, глюкокортикоидов, инсулина. При этом инсулин, андрогены, эстрогены повышают секрецию ИФР-1 печенью, а глюкокортикоиды её снижают. ИФР-1 воздействует на развитие всю жизнь, но его уровень в крови не постоянный: наиболее низкий уровень ИФР-1 производства в детстве и в старости, а самый высокий — во время подросткового периода жизни.
Инсулиноподобный фактор роста (ИФР-1) продлевает жизнь – это один из важнейших стимуляторов роста организма во время пребывания его на стадии плода, а также на этапе раннего детства. Тем не менее в пожилом возрасте он усиливает процессы старения и способствует росту и делению клеток, что часто становится причиной возникновения рака. Каким же образом активация путей IIS и mTOR вносит вклад в фенотип старения?
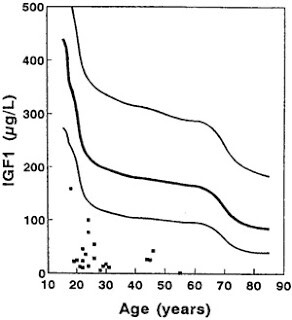
Постоянная стимуляция IIS и mTOR ведет к сокращению жизни и высокому риску возраст-зависимых заболеваний через снижение аутофагии, нарушения в функционировании митохондрий, повышение агрегации белков (так как TOR ведет к образованию белков) и уровня воспаления.
Поэтому излишек углеводов и белков в рационе способствует атеросклерозу, остеопорозу, нейродегенеративным заболеваниям, раку, нечувствительности к инсулину. Подобные механизмы вписываются в парадигму, согласно которой процесс старения — это следствие чрезмерной стимуляции клеток во взрослом организме посредством постоянной «бомбардировки» питательными веществами, ростовыми факторами и митогенными стимулами.
Плохой полицейский и хороший полицейский.
Обращаю ваше внимание, что гормон роста (соматотропный гормон, СТГ) у многих людей с инсулинорезистентностью обычно снижен. СТГ в норме оказывает стимулирующее влияние на экспрессию гена ИФР-1 при условии достаточной секреции инсулина и нормальной восприимчивости к нему периферических тканей. Так, гипогликемия является стимулом к запуску контринсулярных гормонов, в том числе СТГ. У больных СД2 гиперинсулинемия не оказывает стимулирующего действия на экспрессию СТГ, так как инсулинорезистентность обусловливает увеличение глюкозы в крови. Кроме того, ИФР-1 уровень которого у больных СД2 повышен, по принципу обратной связи может подавлять продукцию СТГ. Такой гормональный профиль у больных с СД2 и абдоминальным ожирением также способствует отложению жира в депо, так как СТГ тормозит превращение глюкозы в жиры и вызывает липолиз.
Снижение СТГ у больных с ожирением, гиперлипидемией, гиперинсулинемией сопряжено с повышением ИФР-1 и других ростовых факторов, принимающих участие в ремоделировании сосудистой стенки и в механизмах стимуляции деления клеток многих типов. Маркером, отмечающим границу между дегенеративными процессами старения и болезнями старения с пролиферативной активностью, может служить разобщение действия СТГ и ИФР-1.
Не исключается, что биологическая целесообразность возрастного снижения уровня СТГ заключается в защите организма от прогрессирующих диабетогенных метаболических нарушений, а возрастное снижение экспрессии ИФР-1 — от неопластических процессов. Уменьшение СТГ и ИФР-1 пропорционально возрастному уменьшению способностей к элиминации балластных продуктов и эффективной регенерации клеточных структур, возможно, является физиологическим сигналом к уменьшению потребления пищи.
Старение и инсулиновый каскад.
Влияние опосредуемого инсулином и IGF-1 сигнального механизма на продолжительность жизни сохранились в ходе эволюции. Системное подавление этого механизма, также как и избирательная стимуляция активности фактора транскрипции FOXO (аналога DAF-16) в жировой ткани продлевает жизнь мух-дрозофил. У инбредных линий мышей также обнаружена выраженная обратная взаимосвязь между уровнем IGF-1 и продолжительностью жизни. Аналогичным эффектом обладают также мутации, подавляющие активность рецепторов к инсулину и IGF-1, а также других белков-участников сигнального механизма. Схожая взаимосвязь наблюдается и у собак. Существуют данные, согласно которым собаки низкорослых пород, имеющие мутацию, снижающую активность IGF-1, живут дольше крупных собак. Однако для мух-дрозофил и мышей существование взаимосвязи между размером тела и продолжительностью жизни не подтвердилась.
Доказательства влияния ИФР1 каскада на продолжительность жизни были показаны на различных моделях млекопитающих. Хорошим примером могут быть карликовые мутантные мыши, дефицитные по гормону роста. Такие мыши не только долго живут, у них замедленно старение иммунной системы (клеточное старение), перекрестные сшивки коллагена, замедлено старение летальных заболеваний и случайных патологических процессов, таких как артриты. Также, у грызунов, которых посадили на диету (ограниченное питание), наблюдалось снижение уровня инсулина и ИФР1. Снижалось количество запасаемого жира, стимулировалась иммунная система. Продолжительность жизни возрастала на 30-40 %. Генетические модели также показали влияние ИФР1 каскада на продолжительность жизни.
В 2009 году было проведено исследование на группе пожилых европеоидов. Исследовали 30 генов insulin/ИФР1-сигнального пути. В ходе этого исследования были найдены SNP, достоверно связанные с продолжительностью жизни. Один из этих SNP был найден в гене AKT1. И еще две SNP в гене FOXO3A были связаны с продолжительностью жизни у женщин. Для человека важную роль играет соотношение ГР/ИФР1. При относительно большом количестве гормона роста (при недостатке ИФР1) могут развиться такие симптомы, как ожирение, умственная отсталость, непереносимость глюкозы (синдром Ларона)
По аналогии с другими животными, у млекопитающих ИФР1-каскад негативно регулирует факторы трансляции генов FOXO. FOXO — это сильно консервативное у млекопитающих семейство генов, необходимых для выживания организма в стрессовых условиях. Более того, при редукции ИФР1 сигнала у мышей наблюдалась бОльшая устойчивость к оксидативному стрессу. Таким образом, на мышах, моделированных для изучения болезни Альцгеймера, было показано комплексное влияние ИФР1-каскада на защитные системы организма.

Инсулиновый каскад и раковые болезни.
Путь ИФР сигнализации имеет патогенную роль в развитии рака. Исследования показали, что при повышенном уровне ИФР усиливается рост раковых клеток. Увеличение уровня ИФР-1 связано с повышенным риском возникновения основных типов рака, включая рак толстой кишки, молочной железы и простаты. Такие виды рака стимулируют митоз (деление клеток) и задерживают апоптоз (процесс отмирания клеток). Это значит, что ИФР-1 не только способствует распространению раковых клеток, но также не дает иммунной системе идентифицировать и уничтожить аномальные клетки до того, как они станут раковыми (то есть препятствует возникновению апоптоза).
Более того, по мере нашего старения высокая циркуляция уровня ИФР-1 способствует делению поврежденных клеток, которые в противном случае не стали бы злокачественными. Повышенный уровень ИФР-1 также способствует росту и пролиферации клеток опухоли и повышает их выживаемость, адгезию, миграцию, степень проникновения, ангиогенез и метастатический рост. Сокращение уровня ИФР-1 у взрослых вызывает сокращение окислительного стресса, уменьшение воспалений, улучшение чувствительности к инсулину и увеличивает продолжительность жизни.
По данным Европейского проспективного исследования раковых заболеваний и питания установлено, что повышенный уровень ИФР-1 увеличивает на 40 % риск развития рака груди у женщин старше пятидесяти лет. Другими словами, высокий уровень ИФР-1 способствует появлению распространенных типов рака и провоцирует появление слабоумия, в то время как низкий уровень ИФР-1 позволяет поддерживать работу мозга в пожилом возрасте.
Повышенное содержание ИФР-1 было обнаружено у пациентов с болезнью Альцгеймера, а его уменьшение снижало симптоматику этого заболевания. В случае мышечных тканей, которым в пожилом возрасте требуется ИФР-1 для правильной работы и восстановления, локальное производство ИФР-1 за счет мускульного напряжения хватает для поддержания ИФР-1 на нижних уровнях допустимых показателей. Так что низкий уровень инсулиноподобного фактора роста у взрослых людей способствует долголетию и не имеет никаких очевидных недостатков.
Хороший ИФР-1.
Как и у любой медали есть 2 стороны, так и много хорошего есть и у ИФР-1. Способность к росту важна для обновления и репарации клеток. ИФР-1 важен для многих функций гормона роста, стимулирует рост костей и других тканей организма, а также способствует увеличению мышечной массы. Гормон роста и ИФР-1 стимулируют пролиферацию эндотелиальных клеток сосудистой стенки, ангиогенез в целом, репарацию нервной ткани, утилизацию глюкозы клетками мозга.
Снижением продукции СТГ и ИФР-1 обусловлены такие старческие изменения, как ухудшение внутриклеточного синтеза белка, дистрофические изменения кожи, потеря костной массы, когнитивные нарушения, иммунодепрессия, сосудистая недостаточность. Старение характеризуется нарушением репаративных процессов. Клетки, неспособные к репарации, получают команду к запрещению деления, а при критической массе повреждений — к массовому самоубийству клеток в жизненно важных органах. Но активность ИФР-1 необходимо ограничивать, чтобы не проявлялись ее негативные свойства.
Гиперинсулинемия и раковые заболевания.
Чем меньше у человека чувствительность к инсулину, тем более высокий уровень этого гормона у него будет вырабатываться.
Многоголовая гидра: метаболический синдром и болезни цивилизации.
Это состояние называется нарушенная толерантность к глюкозе. У больных с СД2 (сахарным диабетом) и абдоминальным ожирением изменение чувствительности к инсулину и некоторые другие приобретают патологический характер, соответственно, увеличивается риск развития онкозаболеваний. В настоящее время доказано, что у лиц, страдающих СД, риск таких злокачественных новообразований, как рак печени, поджелудочной железы, колоректальный рак и рак тела матки значительно выше, чем в популяции в целом. Относительно рака молочной железы, яичника, почек мнения исследователей расходятся.

По ряду данных, нарушенная толерантность к глюкозе более опасна как фактор онкологического риска, чем манифестный СД2. Частота злокачественных новообразований у больных с СД2 выше, чем при гестационном диабете; а у больных с гестационным диабетом она выше, чем при СД 1. Такая закономерность отражает патогенетическую связь неопластических процессов со степенью гиперинсулинемии. Как подтвердило 5-летнее проспективное наблюдение, при одной и той же локализации карцином риск рецидивов и смерти повышен у больных с гиперинсулинемией. Гиперинсулинемия способствует также злокачественному течению рака предстательной железы.
Вышеприведенные данные указывают на вероятность связи между риском возникновения злока-чественных новообразований и экспрессией генов, ассоциированных с продукцией инсулина и чувствительностью к нему периферических рецепторов (например, генов рецепторов лептина, фактора некроза опухоли, ИЛ-6 и т.д.).
Повышенная секреция инсулина у больных с СД2 и ожирением вызывает увеличение уровня ИФР-1, стимулирующего усиленное деление клеток. Важно учитывать также, что гиперинсулинизм в патогенезе СД2 сопровождается гипергликемией, образованием конечных продуктов гликирования и активных форм кислорода. Активные формы кислорода способны повреждать цитоплазматические и митохондриальные мембраны, влиять на утрату теломер, снижать интенсивность репарации ДНК и в связи с этим — на угасание способности клеток к воспроизводству.
Снижение калорийности и mTOR
Результаты гено- и фенотипического анализа свидетельствуют о том, что хроническое голодание увеличивает продолжительность жизни червей, мух-дрозофил и мышей посредством подавления активности TOR. Опосредуемый TOR механизм регулирует процессы аутофагии и трансляции. Фактор транскрипции PHA-4 необходим для аутофагии и влияет на экспрессию генов стресс-реакции в условиях голодания. Его влияние на трансляцию не изучено. У дрозофил снижение активности TOR улучшает клеточное дыхание за счет предотвращения трансляционного ингибирования компонентов цепи переноса электронов. Посредством активации фактора транскрипции SKN-1 в нейронах хроническое голодание также стимулирует клеточное дыхание у червей и, соответственно, продлевает им жизнь. Хроническое голодание продлевает жизнь дрозофил и мышей (по крайней мере, частично) и за счет подавления активности опосредуемого инсулином и IGF-1 сигнального механизма.
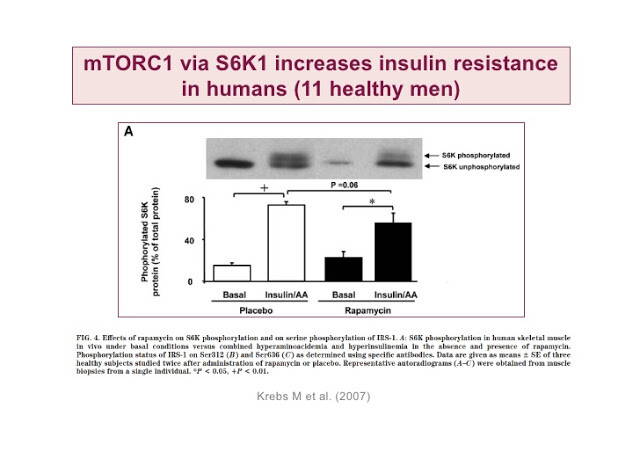
У млекопитающих в ответ на поступление в организм глюкозы происходит подъем уровня инсулина, который можно расценивать как прогностический фактор уменьшения продолжительности жизни. Добавление 2% глюкозы в питательную бактериальную массу укорачивает жизнь C.elegans за счет подавления активности DAF-16/FOXO и HSF-1. Любопытно, что такая диета укорачивала практически до нормальных значений жизнь долгоживущих линий C.elegans с мутациями рецепторов инсулина и IGF-1.
Причины этого неясны, однако, если эта закономерность распространяется и на млекопитающих, мыши с мутациями в генах рецепторов к инсулину и IGF-1, чья продолжительность жизни на 15-40% больше нормы, смогут жить еще дольше на низкоуглеводной диете. В целом эти данные свидетельствуют о том, что такая диета может быть полезной и для человека. Кроме того, они ведут к парадоксальному выводу, что при соблюдении низкоуглеводной диеты заболевания, характеризующиеся нарушением работы рецепторов инсулина, могут способствовать долголетию.
Давление естественного отбора не может быть причиной сохранения обеспечивающих долголетие мутаций, так как оно, в первую очередь, направлено на выживание наиболее приспособленных особей детородного возраста и теряет свое значение по мере старения организма и утраты им способности к размножению. Механизмы, обеспечивающие сдвиг метаболизма в сторону защиты и поддержания жизнеспособности клеток, могли появиться в результате отбора особей, способных с наименьшими потерями переживать неблагоприятные для жизни периоды. Увеличение продолжительности жизни (в том числе и в масштабах эволюции живого) может быть своего рода «побочным эффектом» обеспечиваемого этими механизмами замедления износа метаболических систем организма.
Важно, что сокращение деятельности TOR блокирует устойчивость к инсулину и метаболические синдромы фенотипа, связанные с увеличенной активностью инсулин-зависимого фактора транскрипции, FOXO. Сокращение функции TOR также защищает от возраст-зависимого снижения сердечной функции и увеличивает долговечность.
Работает ли для человека?
Исследование, опубликованное в 2008 году членами американского Общества ограничения калорий, на основе полученных данных показало, что в отличие от снижения уровня ИФР-1 у животных (при сокращенном получении ими калорий) уровень ИФР-1 у людей при таком же сокращении калорий значительно не отличается от уровня ИФР-1 контрольной группы, не менявшей своего высококалорийного рациона.
Ученые были удивлены и поначалу решили, что ограничение калорийности не продлевает человеческую жизнь в такой же степени, как это наблюдалось в случае с животными. Позднее исследователи обнаружили, что исследуемая группа, употреблявшая меньшее количество калорий, потребляла белка больше в процентном отношении к общей сумме калорий животного, чем группа, питавшаяся привычной высококалорийной жирной пищей.
Очевидно, что животный белок препятствовал снижению уровня ИФР-1. Когда они сравнили этот неожиданный уровень ИФР-1, присутствующий у участников наблюдения, с уровнем ИФР-1 у строгих вегетарианцев, то увидели значительно более низкий показатель ИФР-1 у веганов, хотя количество потребляемых ими калорий не ограничивалось. Это объяснило отсутствие ожидаемых преимуществ от ограничения калорийности у субъектов исследования.
Позднее были проведены и другие исследования, касающиеся данного вопроса, в конечном итоге давшие количественную оценку разницы уровней ИФР-1 и потенциального повышения ИФР-1 в случае всевозможных диет и продуктов на примере сорока семи тысяч участников и подтвердившие, что потребление животного белка способствует повышению уровня ИФР-1.
Но сильное ограничение для стариков белка приводит к ухудшению показателей здоровья и потере костной массы. Таким образом, наиболее выигрывающая возрастная группа (от ограничений мяса) - это 45-65 лет.
Акне.
Эпидемия акне (прыщей): вершина айсберга.
Уменьшение инсулинового каскада существенно улучшает выраженность проблем с акне. В 2005 году эффективность диетического вмешательства изучалась в хорошо спланированном контролируемом исследовании с участием пациентов с акне. Предписанная экспериментальной группе диета состояла на 25% из белков (от общего количества калорий), 30% — жиров, а остальные 45% приходились на углеводы, имеющие, к тому же, низкий гликемический индекс. Рацион контрольной группы, напротив, базировался в большей степени на углеводах, гликемический индекс при этом не учитывался. В ходе исследования измерялось количество угревых высыпаний и чувствительность организма к инсулину. Спустя 4 месяца с начала эксперимента стало очевидно, что менее углеводная диета, основанная на продуктах питания с низким гликемическим индексом, способна улучшить симптомы акне и одновременно «сгладить» гормональный фон – повысить чувствительность к инсулину. В качестве побочного эффекта (или бонуса!) в экспериментальной группе была отмечена «попутная» нормализация веса участников. Как видим, «чисто внешние», косметические проблемы могут быть напрямую связаны с общими показателями (не)здоровья: инсулиновой резистентностью, наличием внутреннего воспалительного процесса, очень часто сопровождающимися излишним весом.
Ключевые аспекты диетического влияния.
1. Общий калораж.
Чем выше количество калорий, тем сильнее активируется mTOR. Как говорит народная мудрость, все, что вы переедаете, кормит ваши болезни. Но хроническое голодание (длительное ограничение калорий) имеет существенные недостатки и я не рекомендую его широко. Достаточно не переедать.
2. Доля медленных углеводов в питании.
Чем выше доля быстрых углеводов, тем больше выделяется инсулина при сопоставимом числе калорий. Многие углеводы, которые традиционно считаются «сложными» вроде хлеба или картофельного пюре, увы, ближе к быстрым. Сахар является самодостаточным вредоносным фактором.
3. Режим питания и пищевые комбинации.
Чем чаще человек есть, тем выше уровни ИФР-1 при одинаковом числе калорий. Периодическое воздержание позволяет защищаться от избытка ИФР-1. Добавление продуктов с высоким инсулиновым индексом повышает индекс базового блюда (макароны с сыром). Максимальный выброс ИФР-1 приходится на комбинацию мясо+высокоуглеводистый продукт с высоким гликемическим индексом (вроде мяса с картошкой).
Периодическое голодание также увеличивает продолжительность жизни, причём через сигнальный путь, отличный от такового для общего ограничения калорий. Периодическое голодание увеличивает продолжительность жизни гораздо сильнее, чем постоянное ограничение калорий. А также улучшает функцию мозга: периодическое голодание (пост) и здоровый мозг.
Такой режим может увеличить продолжительность жизни даже тогда, когда общее потребление калорий уменьшается незначительно или не уменьшается вовсе. Само отсутствие пищи может служить сигналом в определении продолжительности жизни, независимым от общего количества поглощаемых калорий и даже более мощным. Исследования показали, что эти сигналы идут через различные молекулярные пути.
Как меньше жрать и дольше жить.
Периодическое голодание и здоровый мозг.
4. Ограничение по некоторым животным продуктам.
Ограничение молочных и мясных продуктов с возрастом имеет существенный защитный эффект и снижает уровень ИФР-1 сильнее, чем ограничение калорий. Подробно об этом было в предыдущей статье.
Кроме того, сигнал от инсулинового рецептора (он же рецептор фактора роста) распространяется по клетке и активирует белок mTOR, что приводит к сборке двух функциональных комплексов: mTORC1 и mTORC2. В свою очередь комплекс mTORC1 может ингибировать субстрат инсулинового рецептора (insulin receptor substrate, IRS). mTOR также активируется аминокислотами, поэтому высокая концентрация аминокислот в крови снижает чувствительность клеток к инсулину.
Заключение.
Разумеется, это лишь ключевые сигнальные пути, есть еще их ряд. Таким образом, управление метаболическими процессами, восстановление нормальной активности иммунной системы — доступные терапевтические стратегии, способные увеличить продолжительность жизни. Профилактика болезней накопления и регуляции в старшей возрастной группе может существенно снизить статистику смертности не только от острых сердечно-сосудистых событий, но и ряда онкозаболеваний.
Автор: врач Андрей Беловешкин
Будем на связи
© Академия ресурсов здоровья, 2016-2023
Индивидуальный предприниматель Чудова Ирина Владимировна, ИНН: 525703771563


авторизуйтесь